
臨床研究法は、相次いで生じた研究不正事件を踏まえ、特定臨床研究の実施に法的規制を課すことで研究不正を防止し、研究対象者をはじめとする国民の臨床研究に対する信頼を確保することを目的として制定された法律です。
臨床研究に関する資金提供について製薬企業等に契約の締結と公表を義務付けたり、厚生労働省の認定を受けた審査委員会が実施計画や疾病等発生時の対応を審査したりすることで、公正かつ適切な臨床研究が行われる体制が整いました。
(厚生労働省HP)
臨床研究法の施行に伴い、厚生労働省が整備するデータベース(jRCT:Japan Registry of Clinical Trials)への登録が必要となりました。
このシステムは、医療機関等で実施される臨床研究について、臨床研究法の規定に基づき、厚生労働大臣に対して、実施計画の提出などの届出手続を行うためのシステムです。
また、同法に規定する臨床研究実施基準に基づき、世界保健機関(WHO)が公表を求める事項や研究過程の透明性確保及び国民の臨床研究への参加の選択に資する情報についても公開しています。
なお、特定臨床研究以外の研究におかれましては、従来通りのデータベース登録を行ってください。
(その他の臨床研究のデータベース登録はこちら)
臨床研究法で遵守が義務付けられているものは以下のとおりです。
産学官における協力研究の推進により、臨床研究分野における協力関係が複雑化している状況において、今後、産学官の協力関係の一層の強化が必要となりました。特定臨床研究において、医薬品等製造販売業者等の関与状況(利益相反状況)を把握し、適正に管理するとともに、透明性を高めることにより、国民の臨床研究に対する信頼の確保を図ることで、適切な臨床研究を推進することを目的としています。
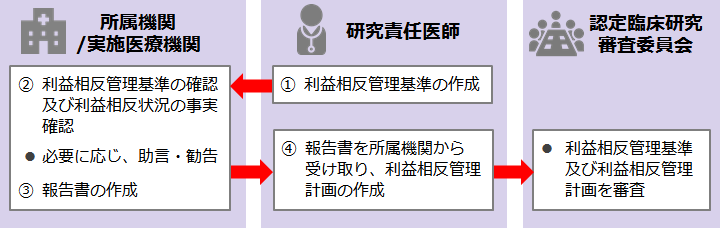
利益相反申告が必要な者
研究責任医師 、研究分担医師 、統計解析責任者 、当該研究実施により利益を得る事が明白な者(当該臨床研究に関係する特許保有者、公的資金等獲得者)
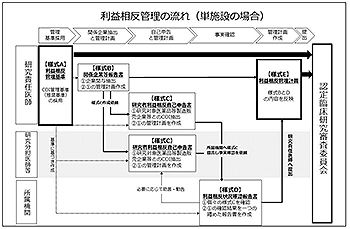
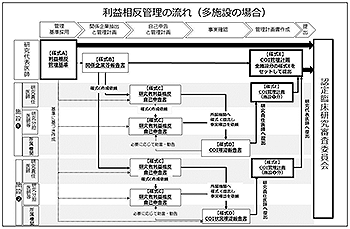
※画像をクリックすると大きいサイズで開きます。
(元データ:厚生労働省HP)
利益相反管理基準書様式(COI様式A-E)
※COI様式 ”D” については、当院の総務課へ様式 ”C” を提出後に総務課で作成されます。
そのため、COI様式 ”C” については総務課(3318)へ提出をお願いいたします。
COI様式の流れについては学内の方はこちらのページをご参照ください。
学外の方はこちらのページをご参照ください。
特定臨床研究を実施する医師は、特定臨床研究の対象者ごとに、医薬品等を用いた日時及び場所、その他厚生労働省令で定める事項に関する記録を作成し、保存することが義務付けられています。
保管が必要なものは、以下の通りです。
| 作成・保存が必要な記録 | 記録とともに保存が必要な書類 |
|---|---|
|
|